代谢物与表型最为接近!一方面,代谢物能反映生物体的真实生理状态,代谢物的变化直接导致表型的变化。相比于其他组学,代谢组受环境影响最大,环境对生物体的影响也是最终体现为代谢物的变化。但是单独代谢组检测,无法解释影响表型的基因机理,相反,转录组的表达不能直接证明表型是否发生变化。为了结合转录和代谢的优势,我们可以进行转录组+代谢组的联合分析,同时实现从“因”和“果”两个层面来探究生物学问题,相互间进行验证,从海量的数据中筛选出关键基因、代谢物及代谢通路,深度解析生物系统的宏观发育过程,解释生物过程的复杂性和整体性。
代谢物是植物表型(功能)的物质基础,园艺植物包括水果、蔬菜、花卉等,具有丰富的颜色性状和品质性状,这些性状和功能的物质基础是研究的热点方向。华南农业大学园艺学院张凌云老师团队近期在《Frontiers in plant science》上发表关于代谢组和转录组的联合分析,揭示了茶树BP型色泽与香气的关系,确定了花青素运输相关途径中的基因表达谱。
期刊:Frontiers in plant science
IF: 5.753
文章:Xin Mei, Shihua Wan et al., Integration of Metabolome and Transcriptome Reveals the Relationship of Benzenoid-Phenylpropanoid Pigment and Aroma in Purple Tea Flowers (2021).
日期:2021-11-23
DOI :10.3389/fpls.2021.762330
合作单位:华南农业大学
研究背景
苯类化合物,尤其是苯丙烷,是植物颜色和香气的主要来源,它们帮助植物吸引传粉动物或阻止外敌侵害。类苯和类苯丙烷(BPs),例如类黄酮,是一组次级代谢产物,来源于莽草酸途径中的两种芳香族氨基酸苯丙氨酸(Phe)和酪氨酸。
茶叶之所以成为一种受欢迎的非酒精饮料,其多样性和丰富的香气是两个原因。茶叶中的主要挥发性BPs为2-PE、Balc和MeSA,而AP和1-PE在茶花中是独特的。挥发性BPs和非挥发性BPs有一个共同的上游合成途径。它们都来源于苯丙氨酸,苯丙氨酸是由莽草酸途径产生的,苯丙氨酸分别进入苯丙氨酸代谢和合成途径。前者继续形成挥发性BPs,后者形成类黄酮,包括花青素。研究BP色素和香气的理想材料最好是含有尽可能多的花青素和挥发性BP。紫娟是一个特殊的茶树品种,有紫色的芽、茎和叶,但仍然缺乏AP和1-PE。此外,和其他茶叶品种一样,紫娟的花也是白色的,这意味着花青素的含量较低。然而在中国广东省白塘镇的茶园里找到了一份完美的材料,一种自然突变的品种(BT;C.sinensisvar.Baitang)有紫色的叶子和花。这个品种为研究BPs在茶树中的代谢以及BPs引起的色香味关系提供了更好的模型。
作者将茶花重新划分为三个阶段,即成熟花蕾(阶段1)、开花前(阶段2)和开花(阶段3)。此外,花香一般会在开花后大量释放,考虑到早期花青素的形成和香气的量,该研究选择了阶段2作为实验对象。
在这项研究中,为了研究挥发性和非挥发性BPs对紫色茶花的气味和颜色的作用,在白色(ZJ品种)和紫色(BT品种)茶花瓣中测定了BP型香气和花青素(图1),确定了生物合成和花青素运输相关途径中的基因表达谱,并分析了调节ZJ和BT之间气味和颜色变化可能的TFs。
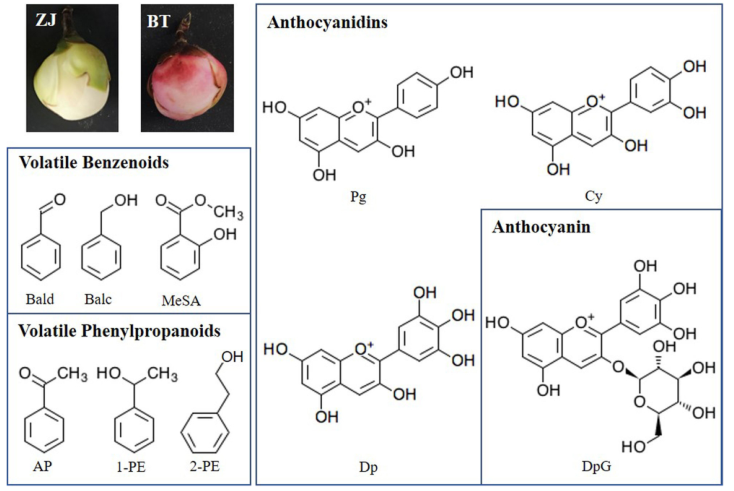
图1 检测到白色和紫色茶花及其主要苯类-苯丙烷(BPs)的结构
实验材料与方法
实验材料:在广东省白塘镇的茶园中培育了紫茶花BT和白花茶花ZJ。采摘第2阶段(开花前)的花朵,收集花瓣液氮速冻,-80℃保存。
实验方法:百迈客转录组测序平台:Illumina HiSeq 2500,紫茶花BT和白花茶花ZJ各3各生物学重复。代谢组:GC-MS
主要结果与分析
挥发性苯类-苯丙烷类及相关基因分析
在白色和紫色茶花中,最丰富的挥发性苯化合物(BPs)是MeSA和AP、1-PE。在白色茶花中,MeSA是主要的挥发性BPs,相对于白色茶花,紫色茶花中的AP高出2倍。除MeSA外,其他常见挥发性BPs在紫色花朵中显著升高:1-PE、Bald和Balc分别为高出2,2.9,2.8倍;而在白花中没有检测到2-PE。总体上,紫茶花中的BPs发生了变化,其中苯丙烷类(AP、1-PE和2-PE)高于其他苯类(Bald、Balc和MeSA),而在正常的白色花朵中,则相反,这表明紫色茶花中苯丙烷类化合物的合成途径被促进。
然后,作者研究了四种直接合成苯甲酸苄酯、MeSA、2-PE和AP的基因,分别是苯甲醇邻苯甲酰转移酶(BPBT;KO id为K19861)、水杨酸羧基甲基转移酶(SAMT;KO id为K21483)、苯乙醛还原酶(PAR)和短链脱氢酶/还原酶(SDR)。他们都在紫色茶花中高表达。通过柱状图分析了两个品种之间存在显著差异的22个SDR基因成员。在紫色茶花中,22个SDR基因的总表达量高出1.3倍,其中表达水平最高的成员(TEA025281)也是如此。BPBT和PAR表达水平较低,分别为15和5倍。两个SAMT成员在茶花中高度诱导,在紫色花瓣中高出3-4倍。这些结果证明紫茶花中挥发性BPs的生物合成能力更强。
图2白色和紫色茶花中挥发性苯丙酸(BPs)及其相关基因的含量
非挥发性苯类-苯丙烷类及相关基因分析
在这两个品种的花瓣中共检测到20种花青素,其中5种花青素为苷元,分别为Pg、Cy、Dp、Pn和Pt。两种花色茶花中都有两到三种花色苷未检测到,即:白色茶花中的petunidin-3-O-(6’’-O-p-coumaroyl)glucoside-5-O-rhamnoside,cyanidin-3-O-(6’’-O-caffeoyl-2’’-O-xylosyl)glucosid和
pelargonidin-3-O-glucoside
,以及紫色茶花中的cyanidin-3-O-(6’’-O-p-coumaroyl)rutinoside-5-O-glucoside 和
cyanidin-3-O-caffeoylsophoroside(图3A)。这20种花青素的总含量紫色花瓣比白色花瓣高1.9倍。根据苷元类型,20种花色苷可分为2个Pg、11个Cy、1个Dp、2个Pn和4个Pt,其中Cy和Dp是主要的苷元(图3B)。
Dp只有一种糖苷形式,但它在紫色花瓣中含量丰富。紫色花瓣中的主要花色苷是delphinidin-3-O-glucoside,Cy-3-O-(6’’-O-p-coumaroyl)glucoside, Cy-O-syringic acid, Cy-3-O-glucoside和Cy-3-O-galactoside, 而在白色茶花中,则是 Cy-3,5-O-diglucoside,
Pt-3-O-glucoside-O-arabinoside, Cy-3-O-(2’’-O-glucosyl)glucoside和 Cy-3-O-rutinoside 。除苷元外,这20种花青素中的另一半含有13种糖苷和1种丁香酸(图3C)。在白色花瓣中,花青素含量最高的是3,5-O-二葡萄糖苷,而在紫色花瓣中,3-O-葡萄糖苷含量极高。因此,两个茶树品种之间花青素的最大差异是DpG,这可能是紫色花呈紫色的主要原因,以及紫色花瓣中Dp和葡萄糖的生物合成可能已增强。
为了研究花青素生物合成过程,作者对ZJ和BT两个品种的花瓣进行了转录组测序。类黄酮生物合成途径表达谱分析发现每个基因都有多个成员,其中一些在白色花瓣中较高,而另一些则相反(图4)。然而,根据每个基因中存在显著差异的成员的表达总和,发现紫色花瓣中的大多数基因表达下调,尤其是C4H、FLS、LAR和ANR,表达显著降低,但F3’H和F3’5’H明显上调,特别是F3’5’H被提高了8倍,这证明了它在产生Dp中的关键作用。此外,由于ANR的含量很低,Dp不能还原为表儿茶素,因此不能被用于合成DpG,而DpG是由bronze-1(BZ1)催化的。BZ1是一种花青素3-O-葡萄糖基转移酶,也称为UFGT。BZ1基因成员在紫色花瓣中的总表达水平是白色花瓣的3倍。
为了进一步揭示两个茶树品种之间BPs的不同合成机制,检测了上游化合物和基因(图5)。在紫色花瓣中,3-磷酸甘油醛(GA3P)增加了2.9倍,而磷酸烯醇式丙酮酸(PEP)仅为白色花瓣的38%,这表明紫色花瓣中的碳代谢被促进,但它可能不会进入苯丙氨酸的下游代谢。PEP的降低可能是由于高度诱导的3-脱氧-D-阿拉伯庚糖酸7-磷酸合成酶(DAHPS)所致。在紫色花瓣中,DAHPS基因的主要成员TEA028537的表达量高出4.6倍。芳醇脱水酶/预苯酸脱水酶(ADT)催化芳醇生成苯丙氨酸。它的主要成员TEA033282在紫色花瓣中略微升高,高出1.3倍。此外,合成的花青素在显示颜色之前需要运输到液泡中,该过程与谷胱甘肽S-转移酶(GST)、多药耐药相关蛋白(MRP)以及多药和毒素挤压(MATE)有关。把这些显著差异基因的表达量加起来,发现紫色花瓣的总表达量都较高,分别高出1.1, 1. 3和1.7倍。紫色花瓣中这三个基因的主要成员(TEA015341、TEA001531和TEA006958),表达量分别高出6.9, 1. 4,和3.9倍。
图3 非挥发性BPs在白色和紫色茶花之间的差异(p<0.05)。(A) 所有花青素的峰面积;(B)同一苷元的聚集;(C)相同糖基的聚集
图4花青素生物合成相关基因的表达水平
图5 BPs上游生物合成途径中的关键化合物和基因,以及与花青素运输相关的基因在白色和紫色之间的表达量差异
参与苯类-苯丙烷生物合成的转录因子
上述结果表明,在紫色花朵中,最具特征的挥发性和非挥发性BPs分别为AP和DpG。计算了Ps和TFs之间的皮尔逊相关系数,发现这两个茶叶品种之间存在显著差异。AP和DpG的14个TF的相关系数大于0.95(表1)。他们属于AP2/ERF、bZIP、EMP、GATA、HS、MYB、NAC、TCP和WRKY家族,在紫色花种分别高出1.6–6.7倍,其中MYB、AP2/ERF、bZIP、TCP和GATA的表达水平最高。
作者分析了14个TFs与上述结构基因之间的相关性,以发现潜在的调节机制(图6)。大多数TFs与PAR、SAMT和SDR高度相关,这有助于挥发性BPS合成;以及4CL、BZ1、CHS、F30H、F3050H、FLS和LAR,它们有助于非挥发性BPs合成;以及ADT和DAHP在苯丙氨酸上游生物合成中起作用。相比之下,这些TFs并不关注花色素苷运输的特定基因。
图6转录因子(TFs)和结构基因之间的相关性
表1 候选转录因子(TFs)参与苯乙酮(AP)和delphinidin-3-O-葡萄糖苷(DpG)的生物合成
总 结
研究发现在BT紫色花瓣中,BP型香气随着BP型颜色的出现而增加。AP和DpG大量累积,是主要的挥发性和非挥发性BPs,此外莽草酸途径中的结构基因和挥发性BPs的合成得到了促进。类黄酮合成途径的大多数基因被下调,并且流出被引导积累Dp。许多TF参与调节紫色及其相关香气。该研究结果揭示了茶树BP型色泽与香气的关系,为了进一步阐明调控机制,未来需要对相关基因的功能进行更多的鉴定。
图8 紫色与白色茶花中BPs合成相关基因的表达谱比较;绿色和红色箭头分别表示紫色花瓣中较低和较高的部分








