▉ 前言
ADC【(antibody-drug conjugate)🔗点此复习】由抗体、效应分子和连接子三个部分组成。每一部分对ADC的作用都至关重要,但今天我们把目光放在连接抗体和效应分子的连接子上,看看过去5年来,人们对连接子的探索到了何种程度。
对ADC来说,连接子需要承担的任务有两个:第一,它要保证ADC在血液中有较好的稳定性;第二,它要保证ADC能精准地将效应分子在目标位置释放。
连接子在其发展过程中碰到了许多问题,大致有如下几点:
1)无法精准地在肿瘤区域释放效应分子而不在正常组织释放。例如辉瑞的Mylotarg,就是因为连接子不能区域选择性地释放效应分子而导致脱靶毒性,在2010年Mylotarg因肝毒性而撤市,虽然2017年又恢复了上市,但FDA对它打上了黑匣子的标签;
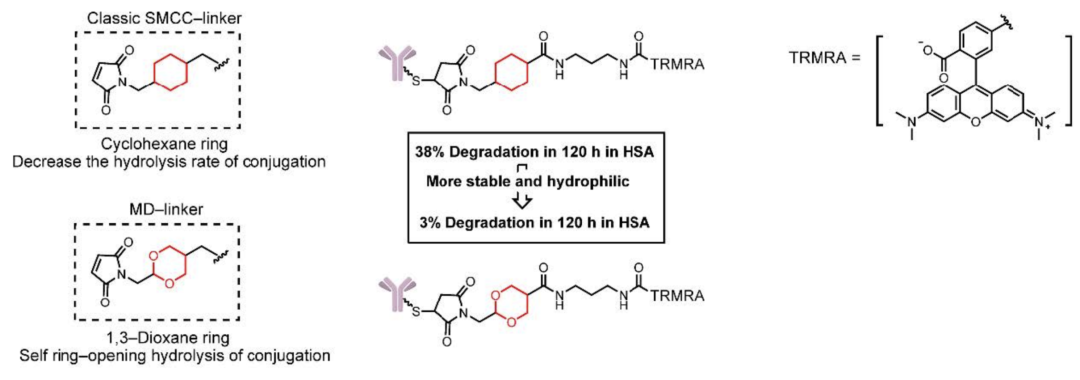
2)丁二酰亚胺连接子发生retro-Michael-addition反应而影响ADC效果。最典型的例子就是琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-甲酸酯连接子(SMCC连接子),这种连接子在血浆中120h后将只剩下38%;
3)连接子与效应分子的连接方式很欠缺。随着人们对ADC的研究越来越多,效应分子的种类也急剧增加,但连接子的种类相对还是比较少,无法跟上效应分子的开发速度。
本文将分两篇从四个方面介绍连接子的最新进展,上篇是连接子的断裂位点、下篇是连接子与抗体的连接方式、连接子与效应分子的连接方式、连接子的ADME特性。
▉ 连接子的断裂位点
连接子的断裂直接控制着效应分子的释放,要想减少ADC的脱靶毒性,就必须设计出具有选择性的断裂位点。
1.1 组蛋白酶解位点
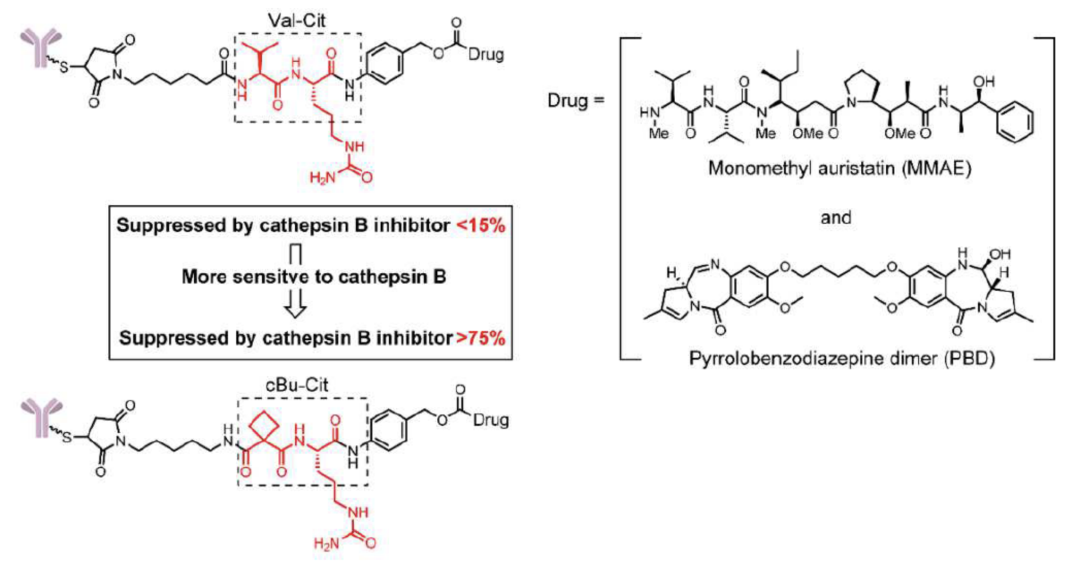
Val-Cit连接子是个典型的例子,这种连接子可被多种组蛋白酶(B、K、L等)水解,导致采用这种连接子的ADC会产生很大的毒性,因为除了组蛋白酶B在肿瘤细胞特异性高表达,其他组蛋白酶在正常细胞也有较高表达。后来将缬氨酸的异丙基替换成四元环后(称cBu-Cit连接子),连接子就只对组蛋白酶B敏感了,大大提高了选择性,与此同时还依旧保持与Val-Cit连接子一致的活性
Val-Cit连接子和cBu-Cit连接子
但是有研究表明,含有缬氨酸(Val)的连接子容易被小鼠血浆中的羧酸酯酶1C(Ces1C)水解,为了解决这一问题,人们又发明了CX连接子。CX连接子由三个甘氨酸构成(图2),在小鼠血浆中具有较好的稳定性,与SMCC连接子相当,同时比SMCC具有更高的体内外活性。
CX连接子
1.2 酸解位点
肿瘤区域的pH值一般在4.0-5.0,而血浆的pH值约为7.4,酸敏连接子就是通过这种差异来发挥作用。Mylotarg和Trodelvy采用的就是这种策略,但它们的稳定性并不是很好,二者在血浆中的半衰期分别是48h和36h。为了解决这一问题,硅脂结构的连接子出现了,它大大增加了ADC的稳定性,血浆半衰期提高到1周以上。
传统的酸敏连接子和硅脂连接子
1.3 GSH断裂位点
胞浆中的谷胱甘肽(GSH)浓度(1-10mmol/L)远高于血浆中的浓度(约5μmol/L),而GSH可以水解二硫键,因此二硫键是一种可能的策略,但二硫键在血浆中的稳定性并不好。为了解决这一问题,人们通过基因工程技术将抗体的特定部位改为半胱氨酸,然后将效应分子通过半胱氨酸直接连接到抗体上,这样二硫键在抗体位阻的保护下降低了水解活性,大大增加了ADC的血浆半衰期。
以上方法仅适用于含有巯基的效应分子,为了扩展到其他效应分子(如MMAE),人们在效应分子前增加了一个带有巯基的连接子——disulfide-carbamate连接子。
图4 GSH断裂位点(A为DM通过二硫键直接连接到抗体,以及MMAE通过disulfide-carbamate连接子连接到抗体,B为PBD二聚体通过disulfide-carbamate连接子连接到抗体)
1.4 二价铁断裂位点
由于肿瘤细胞铁元素的异常代谢会导致游离Fe2+的浓度升高,因此这种特性可以作为ADC连接子的设计策略。TRX连接子是一种对Fe2+敏感的连接子,氧杂环在Fe2+的作用下断裂形成羰基,然后通过β-消除反应释放出效应分子MMAE。但这种连接子仍具有一定毒性,这是由于金刚烷与抗体产生位阻,导致氧杂环容易断裂。为了解决这一问题,人们试图在金刚烷与抗体之间插入PEG链来增加二者的空间距离,以减少位阻导致的副作用。
TRX连接子及其断裂机制
1.5 新型酶解位点
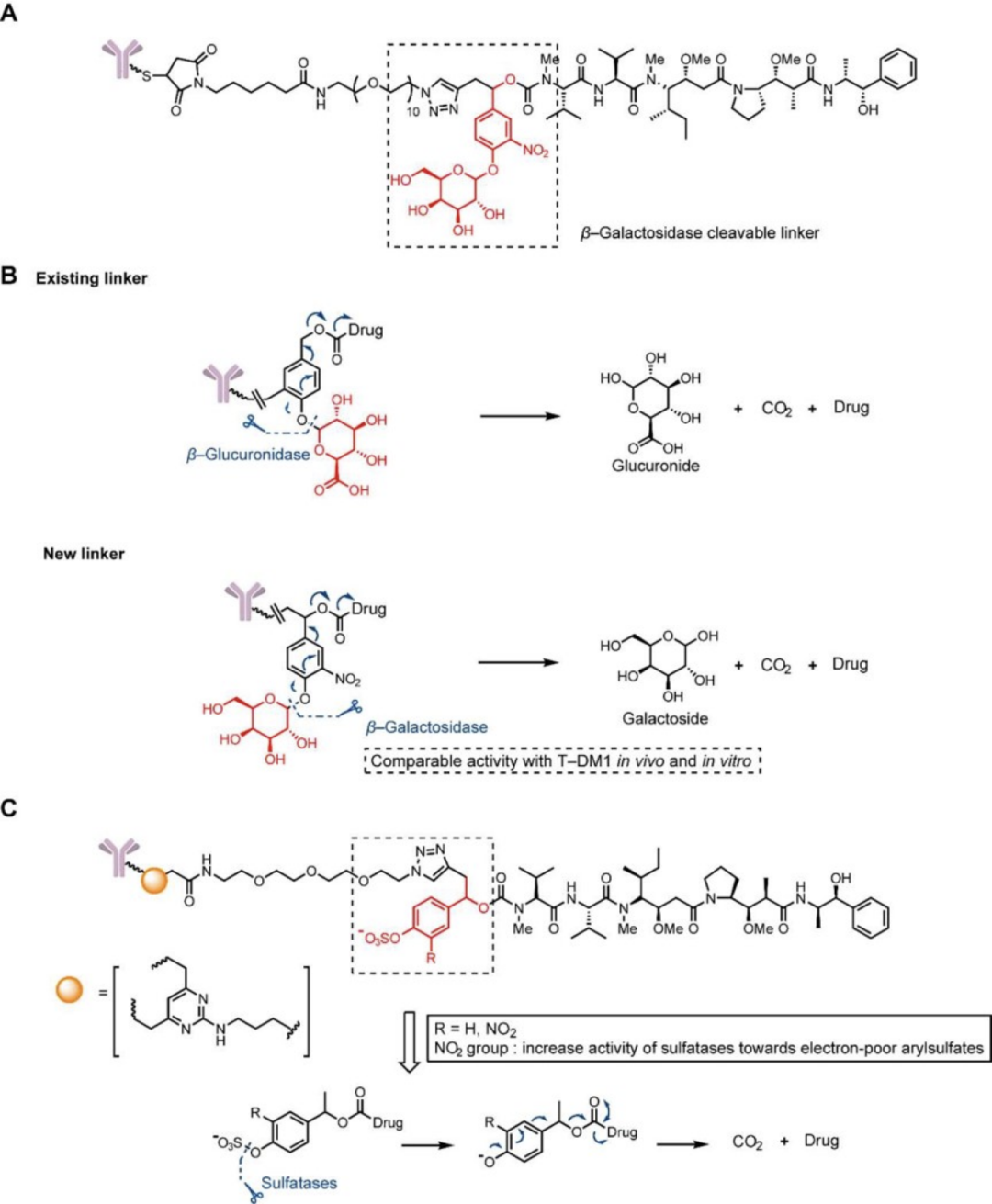
除了组蛋白酶,还有许多其他种类的酶用于ADC连接子的设计。β-葡萄糖苷酸酶是最早的一个 (下图B) ,后来人们还发现了β-半乳糖苷酶也在肿瘤细胞中过表达,并且具有水解活性。于是含有半乳糖苷的连接子出现了 (下图A) ,这种连接子与葡萄糖苷连接子的活性在体内外都表现相当,并且与Val-Cit连接子相比,其体内外毒性都更低。
β-半乳糖连接子及其水解机制(A)和硫酸连接子水解机制(C)
硫酸酯酶也在肿瘤细胞中过表达,它是β-半乳糖苷酶的同源蛋白。与糖苷连接子类似,硫酸连接子中的硫酸被酶水解后,就会释放出效应分子(上图C)。与Val-Ala连接子和Val-Cit连接子相比(半衰期1h),硫酸连接子的血浆稳定性大大提升(半衰期1周以上),但体外毒性有所增加。
磷酸酯和焦磷酸酯可提高连接子的水溶性,可用于携带脂溶性较高的效应分子。起初,为了提高水溶性,人们直接在Val-Cit-PAB连接子后加了焦磷酸酯基团,但稳定性太低(血浆半衰期只有不到6h),这是因为两个位点都可以被水解 (下图A)。后来将Val-Cit-PAB替换为焦磷酸酯连接子(下图B),血浆稳定性大大提高(半衰期1周以上),并且仍然具有较好的水解活性,同时又增加了ADC的水溶性,减少了高脂溶性效应分子的聚集。
焦磷酸酯连接子
1.6 光敏位点
顾名思义,光敏位点可以在特定波长的光照下发生裂解,从而释放出效应分子。相比普通的连接子,光敏连接子往往可控性较高,减少脱靶毒性,并且有明确的断裂机制,此外,其在细胞内的药物释放不会受各种因素的限制(如酶、pH)。
下图A是一种对近红外敏感的连接子,在650-900nm波长照射下可释放出效应分子CA-4。但这种连接子有一定聚集性以及光不稳定性,因此限制了它的使用。下图B是一种对紫外敏感的连接子,这种连接子在自然光下几乎不释放毒性分子,但在365nm波长光照下即可立马释放,在体内实验中,该连接子表现出更长的半衰期,与单独的抗体相当。
近红外敏感连接子(A)和紫外敏感连接子(B和C)
PC4AP(上图C)是另一种对紫外敏感的连接子,这种连接子含有两处相同的断裂位点,当收到365nm波长光照后,首先脱去两个Nv基团,随后抗体上临近的赖氨酸与PC4AP发生分子内加成反应,最终通过消除一份子CO2释放出效应分子。这种连接子在自然光下毒性很小,并且在紫外下的毒力与纯粹的效应分子相当。
尽管如此,光敏连接子还是有它自身的缺陷。对红外敏感的连接子往往具有复杂的结构、自身聚集性、光不稳定性,以及较差的体外药代动力学性质。而对紫外敏感的连接子,其最大的缺陷就是,紫外光本身就会对机体产生较大的伤害,并且紫外光对机体组织的穿透能力较差,无法到达较深的部位。
1.7 不可裂连接子
还有一类连接子不含有化学敏感的位点,称不可裂连接子。SMCC是个经典的例子,但这种连接子稳定性较差,并且水溶性不够好。后来在此基础上,人们将SMCC替换为MD连接子(将环己烷替换为1,3-二氧六环),提高了水溶性和稳定性。
SMCC连接子和MD连接子
还有一种不可裂连接子用于PBD毒性分子,这种连接子如下图所示,它们都包含一条PEG链,苯环用于连接两个PBD分子,只有连接PEG和苯环的部分有所差别,但体内外活性表明只有炔和哌啶的结构效果较好,而三唑环的效果并不理想。
含PEG链的连接子
参考文献:
1.Antibody–drug conjugates: Recent advances in linkerchemistry
https://doi.org/10.1016/j.apsb.2021.03.042
2.Chu Y, Zhou X, Wang X. Antibody-drug conjugates for the treatment of lymphoma: clinical advances and latest progress. J Hematol Oncol. 2021 Jun 5;14(1):88. doi: 10.1186/s13045-021-01097-z.