·了解神经元中出现问题的原因,及导致脑部疾病的细胞和分子过程一直是帕斯卡进行这项研究的动机。许多精神和神经系统疾病在发展过程中根植于大脑——即使症状可能要到数年后才会出现——观察神经元如何发育也许是填补我们理解空白的最佳方式。
将人类大脑样组织移植到只有几天大的大鼠体内,老鼠还是老鼠吗?
10月12日,斯坦福大学的神经科学家Sergiu Pașca (塞尔吉·帕斯卡)教授团队在《自然》(Nature) 杂志发表了题为《Maturation and circuit integration of transplanted human cortical organoids》的研究论文。
这项研究发现,人干细胞来源的类脑组织能与新生大鼠的大脑整合,还会影响大鼠行为。这表明:人们已经找到了一种研究人类神经元的新方法。
了解神经元中出现问题的原因,及导致脑部疾病的细胞和分子过程一直是帕斯卡进行这项研究的动机。许多精神和神经系统疾病在发展过程中根植于大脑——即使症状可能要到数年后才会出现——观察神经元如何发育也许是填补我们理解空白的最佳方式。
帕斯卡表示,该技术或能作为一种很强大的资源,补充对人脑发育和疾病的实验室研究,进一步研究也许能让我们利用患者来源的细胞揭开本来无从了解的疾病特征。
在这项研究中,帕斯卡团队首先将人脑类器官植入新生大鼠大脑的感觉皮层,一开始,这些植入的人脑类器官大约只有5mm长,但在6个月之后,它们占据了大鼠大脑半球的三分之一,且神经元数量达到300万。
在北京时间10月10日晚举行的新闻发布会上,帕斯卡提到,早期移植十分关键,“我们发现,如果我们在早期阶段植入类器官,它会在四五个月的时间内长到比最初大9倍。”
来自干细胞的重建人类神经元,在培养皿中维系并移植到大鼠大脑皮层中。图片来源于斯坦福大学。
在研究中,帕斯卡团队转动大鼠的胡须,发现人脑类器官中的一组神经元出现了活动现象,当人脑类器官被特定频率的蓝光刺激时,它会触发大鼠的条件行为,它们更频繁地舔水瓶,以此来寻求奖励。帕斯卡解释,“这意味着我们实际上已经将人体细胞整合到了大鼠的神经元回路中,成为了大鼠大脑的一部分。”
人类细胞茁壮成长,与老鼠的大脑融合在一起。它们长出血管,提供营养并带走废物,长出一种微妙的通信电缆——轴突,以及多节的刺。图片来源于《自然》杂志。
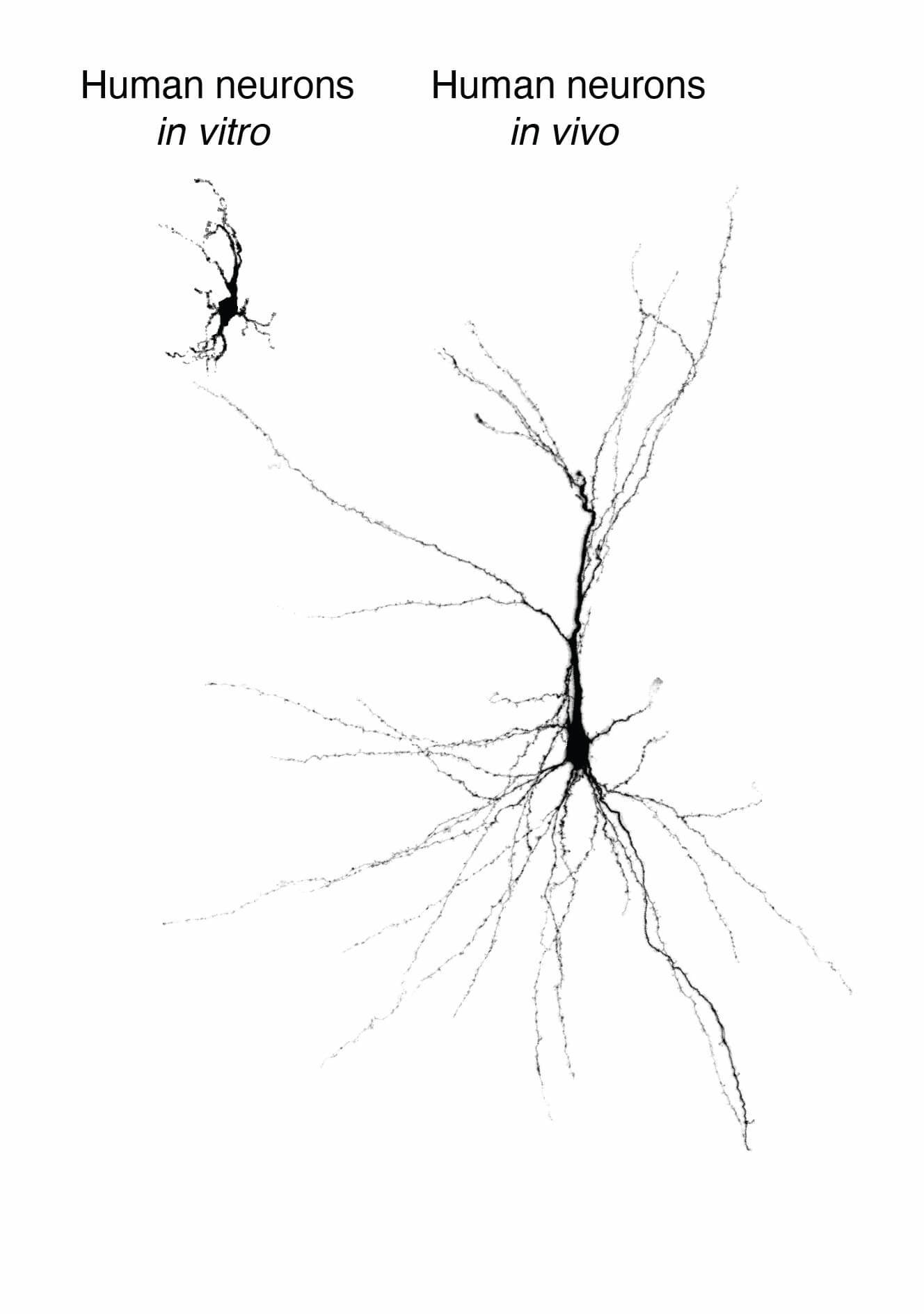
他还提到,他的团队将移植到大鼠大脑的人类神经元与生活在培养皿中的神经元进行了比较,发现移植的神经元大了六倍,并且大小和电活动曲线都更接近于人类脑组织的神经元。
此外,帕斯卡团队还在大鼠大脑中植入了来源于三名蒂莫西综合征(Timothy syndrome,一种与心脏问题有关的严重遗传病)患者的脑类器官,发现移植的携带蒂莫西综合征基因的人类神经元会生长出异常的树突状分支。最关键的是,一些异常的树突分支只能在移植到大鼠皮层内生长的人类神经元中看到,在培养皿中生长的神经元上看不到。这说明,这种植入技术能揭示之前未知的疾病特征。
“这是一项非常必要和优雅的研究,它可以引导该领域朝着正确的方向寻找方法,来提高人脑类器官的生理相关性,模拟人脑发育的后期阶段。”南加州大学神经科学家Giorgia Quadrato表示。
一个用荧光蛋白标记的人类类脑在大鼠的大脑中。图片来源于斯坦福大学。
10月12日,澎湃科技连线南京医科大学药学院特聘教授刘妍,解读人脑类器官研究和应用的现状。刘妍的研究兴趣主要在于人脑类器官构建,细胞治疗研究以及应用诱导性多能干细胞(iPSC)开展神经疾病发病机理的研究。
刘妍认为帕斯卡团队的这项研究最大亮点在于,他们把培养的一部分人脑类器官移植到新生大鼠的大脑,另一部分在体外继续培养,培养或移植至8-9个月的时候,对它们分别作了功能的解析,证明人脑类器官移植到新生鼠体内后,相比同时期在体外培养的类器官,神经元的形态要更丰富一点,电生理及其他神经元功能也要更成熟一些。
“很多精神疾病没有非常好的模型,把病人的类器官移植到动物模型身上,可以部分模拟疾病的病理表型。在活体上进行研究,弥补了类器官体外研究的一些缺陷,比如不能研究环路整合以及不同脑区之间的投射,缺乏真实脑中具有的微环境,以及无法研究行为学等。”刘妍说。
据悉,帕斯卡团队下一步的研究方向是进行药物测试。对此,刘妍表示看好,“把人的神经细胞结合到小鼠体内,就有了病人特有的病理表型,再通过载体的方式给药,如腹腔注射或灌胃,模拟了药物研发过程体内药物递送的过程,这是体外培养的类器官做不到的。动物也有血脑屏障,通过‘人—鼠嵌合脑’的模型可以研究新药对于血脑屏障的通透性,以及通过血脑屏障后对病人的神经元或者病理表型的改善。”
目前来看,人脑类器官的研究仍处于早期的完善模型的阶段。刘妍认为,从药物研发的角度,目前人脑类器官的研究仍然面临着异质性高、缺血管化和难以批量化生产的挑战。
“类器官的异质性是共同面对的挑战,分化的每一个类器官的大小和功能都不一样。要做疾病机制研究的话,还是需要比较高的同质性,不然可能很难得出一个一致结论。其次,体外培养人脑类器官还不是很成熟,目前没有具有血流的血管。再次,人脑类器官的培育是一个精细活,需要科研人员精细培育,目前批量化也比较难。”刘妍解释道。
除此以外,人类类器官的研究一直伴随着伦理争议,所幸的是,帕斯卡团队的研究中,这些老鼠并没有表现出可检测到的人类特征。帕斯卡说:“没有任何证据表明老鼠经历过疼痛、容易癫痫发作,失去记忆或无法控制自己的运动。事实证明,老鼠对人体移植物的耐受性非常好。”
老鼠还是老鼠。类器官研究的再进一步,令人期待。



