文/张洪涛 宾夕法尼亚大学医学院病理及实验医药系研究副教授
核心提要
1. 辉瑞、BioNTech发布了新冠疫苗Ⅲ期实验的第一次中期分析结果,显示出疫苗组的新冠病毒感染率比对照组降低了90%。然而,中期分析结果不能保证疫苗的有效期。并且,疫苗临床试验中“无一例感染”并非好结果,因为这意味着安慰剂对照组的受试者也同样没有感染,无法显示出疫苗的保护作用。
2. 这一款疫苗,是RNA疫苗,由德国的BioNTech公司研发,之后由辉瑞接手进行临床试验,并负责商业化。疫苗试验历时11个月,截止7月底已有 43538例参试者接种两剂疫苗。上海复星医药拥有该疫苗国内权益,将根据国际3期试验的数据,对BioNTech的疫苗进行批准。美国公民第一批接种疫苗的人最快可在今年12月接种。
3. 三期临床试验导致的一名巴西医生的死亡事件敲响了预防警钟,中国国内因为基本没有疫情,不具有开展3期新冠疫苗临床试验的条件。
4. 目前中国有四款疫苗正在全球十多个国家进行3期临床试验,三款灭活疫苗已经在中国获得紧急使用许可。国药集团灭活疫苗开展了国际临床三期试验,超过5万人接种,无一人感染。疫苗安全性目前比较理想,有效性数据可能会在近期公布。
试验为何致94人感染,首个报道三期临床试验的新冠疫苗:90%有效是什么意思?有效期能维持多久?
美国新冠病例超1000万,在最需要疫苗的时候,辉瑞送来了一个希望。
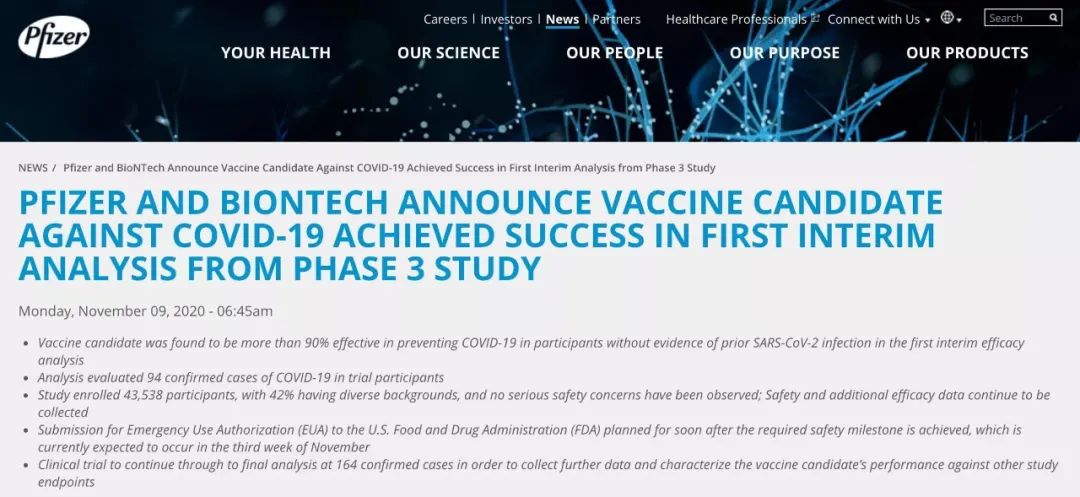
11月9日,辉瑞、BioNTech发布了新冠疫苗Ⅲ期实验的第一次中期分析结果,显示出疫苗有90%的有效率。值得人们关注的还有另一种候选疫苗Moderna,使用的也是与辉瑞相同的平台。国家过敏和传染病研究所的福奇博士认为,这款药物的疗效非常值得期待。辉瑞的消息发布不到两个小时,俄罗斯卫生部立即表示,其Sputnik V疫苗对新型冠状病毒的有效性超过90%。11月10日(当地时间10月9日),巴西卫生机构突然宣布,因一起发生在10月29日的“不良事件”,暂停正在进行的科兴新冠疫苗三期临床试验。具体是由疫苗本身还是对照组引发的不良事件,原因不详。
目前新冠疫情越来越厉害,美国每日新增感染人数已经连续4天超过10万例。在欧洲,第二波疫情也非常严重,法国11月7日的新增数突破了8万人。如今辉瑞和BioNTech发布的疫苗消息,无疑是给全世界打了一针强心剂。
为什么说这款疫苗的有效率是90%?之前各种新冠疫苗都有100%有效的传说,为什么如今90%的有效率,就能让全世界上了巅峰?换句话说,mRNA疫苗BNT162b2或能将新冠肺炎感染病例减少90%以上。这是目前第一份新冠疫苗3期临床试验的数据,之前所谓的“100%有效”,指的是一些疫苗在早期临床试验中,能够让100%的受试者出现抗病毒抗体或者中和抗体。但是,检测到了这些抗体,并不能就绝对地认为接种者肯定获得了免疫保护,不会被病毒感染。
辉瑞和BioNTech疫苗的临床试验,总共招募了43,538个志愿者,由于这是一个双盲的临床试验,参加试验的志愿者不知道自己接种的是新冠疫苗,还是安慰剂,给志愿者接种疫苗的医生、护士也不知道,只有临床研究的“数据和安全监控委员会”才知道。按照原计划,临床试验结果的分析有这样几个时间点:
·第一中期分析时间点:出现32个感染者
·第二中期分析时间点:出现62个感染者
·第三中期分析时间点:出现92个感染者
·第四中期分析时间点:出现120个感染者
·最终分析时间点:出现164个感染者
但是,因为增加了临床试验的人数,如果感染人数只有32人,不能充分进行统计学分析,所以在10月份,经过与美国药监局沟通之后,试验方案得到了修改,放弃了第一个时间点,即“出现32个感染病例”,将中期分析后移到“出现62个感染病例”。如今应该是达到了这个时间点,但是对数据分析后,发现已经有94个受试者感染。
辉瑞没有公布疫苗组具体的感染数,但是从数据上推论,应该是有8人感染,对照组有86人感染,因为受试者是按1:1的比例随机分入两个组,疫苗组的新冠病毒感染率比对照组降低了90%。
| 11月初,辉瑞公司临床试验的一名志愿者在辛辛那提儿童医院医疗中心接受了疫苗接种。
值得提醒的是,这是一个中期分析结果,目前并不知道疫苗的有效期能维持多久,还需要后续的试验结果才能确认。目前这款疫苗需要接种两次,中间间隔21天,目前的结果是在第二剂疫苗接种后7天获得90%的保护率。很显然,在接种完第二剂疫苗之前,免疫保护并不充分,还是会有一定的感染风险。
这个好消息并没有得到所有科学家的祝福,已有人撰文对这一研究以及其他疫苗研究的试验提出了异议,他们担心即使这些研究结果在统计学上是有效的,但在给数十亿人注射疫苗时,这些中期分析可能也无法提供足够的有效证据。显然,关于这种新型疫苗的安全性与有效性,也许我们还有许多未知的领域需要去探索。
其实通过这个新闻,我们也可以了解到这样一个事实:疫苗临床试验中“无一例感染”并不是一个好结果,因为这意味着安慰剂对照组的受试者也同样没有感染,无法显示出疫苗的保护作用。
复盘辉瑞疫苗的研发里程,历时11个月,43538例参试者接种两剂疫苗
这一款疫苗,是RNA疫苗,由德国的BioNTech公司研发,之后由辉瑞接手进行临床试验,并负责商业化。
2018年,BioNTech公司获得了美国宾夕法尼亚大学Drew Weissman实验室的mRNA疫苗技术,开始开发基于该技术的疫苗。在新冠疫情出现之后,BioNTech自然在第一时间开始推进新冠疫苗的项目。
与传统的减毒疫苗、灭活疫苗相比,新型mRNA疫苗的研发流程非常快。
要研发RNA疫苗,并不需要先获得病毒,只需要知道病毒的核酸序列,就可以设计出相应的疫苗。所以,在今年1月10日中国公布了新冠病毒的基因序列之后,核酸疫苗的竞争就开始了。BioNTech从德国政府获得了7.5亿欧元的资金支持,用于推进新冠疫苗的项目。
辉瑞和BioNTech共研究了四种候选的mRNA疫苗,其中两种(BNT162b1和BNT162b2)获得美国FDA的快速通道认定。目前的这款疫苗是BNT162b2 ,是一款经过核苷修饰和密码子优化的mRNA疫苗。BNT162b2接种入人体之后,可以在接种者体内表达一种具有特定构象的新冠病毒刺突蛋白(S蛋白),这种构象是S蛋白与人体细胞上ACE2受体结合所必须的,是病毒感染细胞的关键,也能够诱导产生有效的中和抗体。
7月1日,辉瑞公司在预印本平台medRxiv发布了 mRNA疫苗BNT162b1的1期和部分2期临床试验积极结果,这个发表的研究是第一个公开发表的基于mRNA疫苗技术的临床试验。
| 7月13日美国FDA授予BNT162b1和BNT162b2快速通道。
7月20日,辉瑞公司分享了1/2期临床试验结果,显示BNT162b1诱导产生了比较强的CD8 T细胞免疫反应。结果于8月12日在《自然》杂志上正式发表(1)。根据试验结果,选择了30微克的剂量进行进一步的临床试验。
8月9日,在bioRxiv上发布BNT162b2疫苗在恒河猴中进行的攻毒实验结果。注射过疫苗的恒河猴,在55天后暴露于病毒,显示出保护,没有肺部感染。在鼻拭子和咽拭子样本中,接种BNT162b2的恒河猴只在接受病毒挑战后第一天检测到病毒RNA,在第三天时病毒RNA水平已经无法检测到(2)。
7月27日,BNT162b2的2/3期临床试验正式开始,在全球超过120个中心进行(包括美国、巴西、南非和阿根廷等国家)。本来计划入组3万人,但后来为了尽快获得一定的感染人数,将入组人数增加至4.4万人。目前已经入组了大约43538例受试者,其中超过38955例已经完成了疫苗的第2剂接种。
| BioNTech的总部位于德国美因茨。
辉瑞的疫苗离上市还有多远?复星拥有中国国内的使用权,阿斯利康三期临床出现首例死亡事件
目前的临床试验结果,虽然表明了BNT162b2疫苗有效,但是临床试验不但需要提供有效性,也需要提供安全性的数据。尤其是10月底出现的一例阿利斯康在巴西进行的三期临床试验导致的一名巴西医生的死亡事件,更是将疫苗的安全性摆在了首位。
辉瑞公司不能立即向食品和药物管理局申请紧急授权,按照预定的计划,需要到11月的第三周,在50%的受试者接种疫苗达到2个月之后,表明没有出现严重不良反应,辉瑞公司才会向美国FDA提交疫苗的“紧急使用授权”申请。FDA规定,疫苗有效性超过50%才可获批,辉瑞疫苗显然可以轻松跨栏。所以,从时间上来说,还需要大约一个月的时间,才会获得美国的紧急批准。在美国,预计第一批接种可以在12月开始。
在入组试验的志愿者出现总共164例确诊病例的时候,将进行临床试验的最终分析。该临床试验还将提供对新冠病毒密切接触者的保护率数据,以及对严重感染症状的预防效果。目前美国每天确诊人数已经达到12万人,按照这个速度,只需要再等10天左右的时间,就能达到临床试验所需要的最终感染数。
在10月6日,辉瑞/BioNTech宣布已经向欧洲药品管理局(EMA)提交COVID-19疫苗BNT162b2的滚动申请,EMA已经受理该申请并且人用药品委员会(CHMP)已经启动了滚动审评。
在中国,BioNTech已经于今年3月与上海复星医药签署商业合作协议,由复星医药负责新冠疫苗在中国的临床试验,疫苗报批,及商业销售。目前,复星医药已经在中国开展了BNT162b1的I期临床试验。由于中国国内基本没有疫情,不具有开展3期新冠疫苗临床试验的条件,相信中国将根据国际3期试验的数据,对BioNTech的疫苗进行批准。复星医药高级副总裁、全球研发中心总裁兼首席医学官回爱民表示,BioNTech和复星医药最初就达成了共识,未来将结合BNT162b2的海外2b/3期临床数据及在中国进行的BNT162b1的Ⅰ期临床试验数据,准备BNT162b2在中国的临床桥接试验申请。
“基于国际合作,未来海外的2b/3期临床试验数据也将同步分享给复星医药,以推动BNT162b2候选疫苗未来在中国的临床试验及上市申请。”BioNTech联合创始人兼首席执行官Ugur Sahin表示。
据了解,复星医药拥有该疫苗国内权益。
截止目前,辉瑞已经与美国签署了一份价值19.5亿美元的合同,将向美国提供1亿剂疫苗。同时,日本也将购买1.2亿剂新冠疫苗。辉瑞预计在2021年将生产13亿剂新冠疫苗。这两条生产线一条在美国,一条在欧洲。
辉瑞公司的疫苗官员亚历杭德罗·卡内(Alejandro Cané)称,根据此前宣布的与美国政府达成的19.5亿美元协议,该公司将在12月至3月期间生产1亿剂疫苗。这些剂量的疫苗届时将免费提供给患者。美国公民可免费接种。因此,第一批接种疫苗的人可以在今年12月接种。
| 辉瑞公司首席执行官阿尔伯特·布尔拉博士宣称就疫苗的时间表与特朗普进行了多次接触。布尔拉博士说:“我告诉他,他不应该担心我们会损害安全性或功效,但是我们会在科学允许的范围内尽快这样做。
中国四款新冠疫苗三期临床结果何时官宣,进展如何?5万多人紧急使用“无一例感染”,安全性数据出炉,有效性数据近期公布
目前中国有四款疫苗正在全球十多个国家进行3期临床试验,包括国药集团的两款灭活疫苗,科兴的一款灭活疫苗,康希诺与陈薇院士合作研发的一款腺病毒载体疫苗。目前三款灭活疫苗已经在中国获得紧急使用许可,提供给有感染高风险的人群自愿使用。
虽然目前还没有公布临床试验的数据,但11月6日,在第三届进博会上,国药集团董事长刘敬桢在介绍灭活疫苗紧急使用情况时提到,华为驻墨西哥办事处的员工有99个人,其中81个人在国内接种过灭活新冠疫苗,目前无一人感染,而其余18人没有接种过疫苗,有10人感染。
这虽然不是严格的临床试验数据,但是显示出该疫苗应该有一定的保护效果。国药集团灭活疫苗先后在阿联酋、巴林、埃及、约旦、秘鲁、阿根廷、摩洛哥等十多个国家和地区开展了国际临床三期试验,目前为止,接种人数超过5万人。同时,科兴的灭活疫苗也在巴西等国家开展了临床试验,之前由巴西主持临床试验的布坦坦研究所发表过安全的评论,认为安全性目前比较理想,有效性数据可能会在近期公布。
目前国内的新冠疫情,主要是输入性的感染病例,以及通过冰冻肉类食品而带来的感染。整体上,中国目前的疫情风险非常低,但是也期盼着疫苗的三期临床试验能够顺利获得有效性和安全结果,以促进国际交流的正常化。
参考文献:
1. Mulligan MJ, et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 2020.
2. Vogel A, et al. A prefusion SARS-CoV-2 spike RNA vaccine is highly immunogenic and prevents lung infection in non-human primates. bioRxiv. 2020:2020.09.08.280818.