2月19日,加科思药业(1167.HK)宣布其自主研发的SHP2抑制剂JAB-3312与KRAS G12C抑制剂戈来雷塞联合用药在中国获批注册性三期临床试验,JAB-3312成为全球首个与KRAS G12C抑制剂联合用药获批进入三期注册性临床研究的SHP2抑制剂。
此次在中国获批的是一项随机阳性药对照的三期试验,旨在评估JAB-3312与戈来雷塞联合用于KRAS G12C突变的一线非小细胞肺癌(NSCLC)患者的疗效及安全性,试验的对照组是目前一线非小细胞肺癌的标准疗法,即PD-1抗体和化疗联合治疗。
早期数据被官方认可 CDE批准SHP2抑制剂三期临床
作为学术界长久以来的难成药靶点,SHP2吸引了众多医药巨头投入资源进行研发,罗氏、赛诺菲、BMS、辉瑞等跨国药企都通过License in相继布局。而此次是这一靶点在全球范围内首次获批进入三期临床试验,并且由加科思这一中国创新药企率先实现,一举超越此前进度最快的诺华公司,成为全球第一。
对于广大的KRAS G12C突变患者而言,目前的一线疗法“金标准”为PD-1和化疗联合用药,需要患者进行静脉注射,而SHP2抑制剂和KRAS G12C抑制剂均为口服药,有望填补KRAS G12C突变一线疗法的空白,并且取代静脉注射,为患者提供更加便利的给药方式,无需住院,在家口服即可。
中国医学科学院肿瘤医院内科副主任医师仲佳曾分享,一位曾参加过其他KRAS抑制剂临床试验的耐药患者在服用了KRAS G12C抑制剂戈来雷塞和SHP2抑制剂JAB-3312后,肿瘤评估提示患者的病情得到了非常好的缓解。
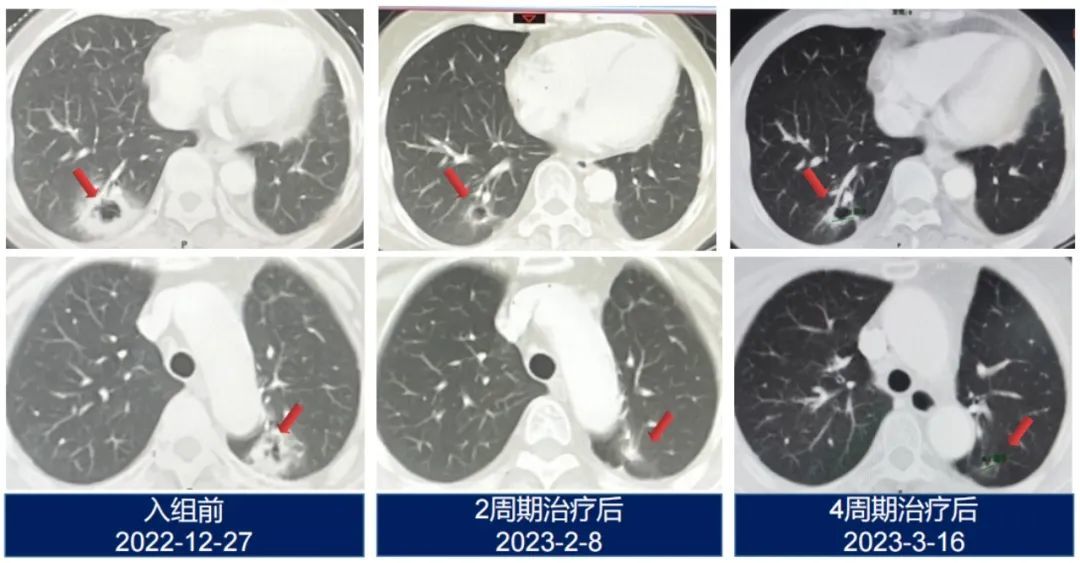
目前PD-1和化疗联合用药的标准疗法客观缓解率为30%-40%,而加科思在2023 ESMO大会上公布的数据显示,在KRAS G12C抑制剂戈来雷塞注册试验剂量800毫克(单药注册试验剂量)及2毫克SHP2抑制剂JAB-3312联用的剂量组中,客观缓解率为86.7%,疾病控制率为100%,数据显著优于标准疗法,试验结果若能在更多患者身上重复,将有较大获批概率。而此次三期临床试验获批,标志着SHP2抑制剂距离正式上市更进一步,有机会将临床价值真正转化为商业价值。
SHP2抑制剂:肿瘤免疫领域的明日之星
作为近年肿瘤免疫领域最为重要的产品,PD-1目前存在单药响应不佳,患者很快产生耐药的问题,部分原因在于患者的肿瘤组织中无明显的T细胞浸润或存在大量的免疫抑制性巨噬细胞,是所谓的“冷肿瘤”。近来科学家发现,SHP2可激活肿瘤免疫微环境,将“冷肿瘤”转变成免疫反应活跃的“热肿瘤”,能有效提高PD-1疗效,这使得SHP2抑制剂有望成为与PD-1联用的基石药物。
而具有“增敏剂”特性的SHP2药物,除与KRAS G12C抑制剂联用外,还有望与加科思自研的KRASmulti抑制剂JAB-23400进行联合治疗。此外SHP2也有望与针对ALK、ROS1、BRAF V600E等靶点的药物联合用药,从而覆盖更广阔的患者群体。
突破不可成药靶点,券商持续看好加科思商业前景
今年1月,天风证券发布研报称加科思为“突破不可成药靶点的小分子创新药黑马”,并预计公司2024年市值为60.92亿港元,目标价7.68港元。据其估算,KRAS G12C抑制剂戈来雷塞2025-2027年全球市场收入可分别达到5.94 亿元、7.02 亿元、13.11 亿元;SHP2抑制剂2027-2029 年全球市场收入12.82 亿元、19.96 亿元、26.68 亿元。
太平洋证券近期分析指出,戈来雷塞联合JAB-3312的客观缓解率远高于PD-1联合化疗的标准治疗,无进展生存期数据也估计将优于标准治疗,结合公司总体业务情况更新,测算出目标市值为53.71亿元人民币,对应股价为7.41港元,维持“买入”评级。
