张学文, 戴朝六
中国医科大学附属盛京医院
肝细胞癌(HCC)易侵犯门静脉并形成门静脉癌栓(PVTT),关于HCC合并PVTT的治疗争议较大。欧美国家将HCC合并PVTT归为巴塞罗那肝癌分期(BCLC)C期,唯一推荐的治疗方式是索拉非尼。而包括我国在内的亚洲国家却认为以手术切除治疗为主的多学科综合治疗可以获得更为满意的疗效。目前,HCC合并PVTT缺乏合理有效的治疗规范,循证医学证据的级别仍不高,并未形成治疗指南。
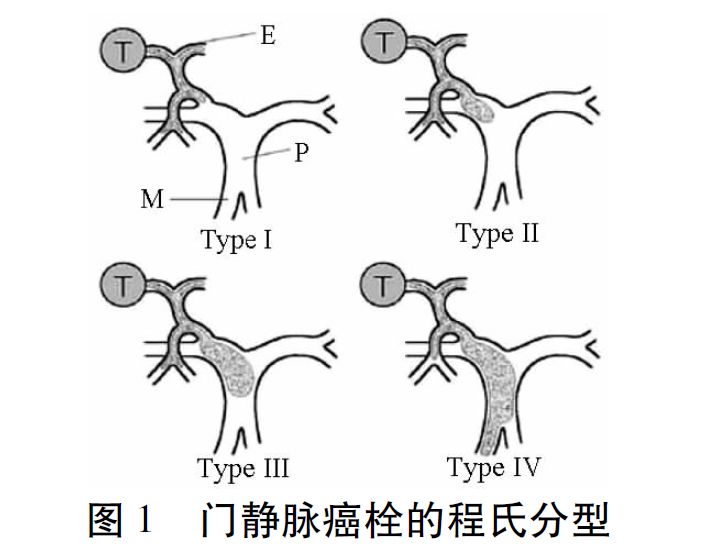
PVTT首次治疗方式选择
手术治疗
目前,手术切除治疗是HCC合并PVTT Ⅰ及Ⅱ型患者的首选并有可能获得根治机会的治疗方法。我国2016年版肝癌合并PVTT专家共识中指出:肝功能Child-Pugh A级、原发病灶可切除、PVTT Ⅰ及Ⅱ型、ECOG PS 0~1分患者首选手术治疗。张修平等总结了手术切除治疗HCC合并PVTT有以下优点:(1)降低患者肿瘤负荷;(2)降低门静脉压力,从而降低上消化道大出血的风险;(3)恢复门静脉血流,改善患者的肝功能状况;(4)延长部分PVTT患者的生存期;(5)提高生活质量。
对于原发病灶可切除的、肝功能良好的Ⅰ及Ⅱ型PVTT患者手术治疗应作为首选,Ⅳ型PVTT目前不建议手术治疗,Ⅲ型建议优先考虑介入治疗。
复发是HCC合并PVTT患者术后死亡的主要原因,因此降低术后复发率显得尤为重要。近年来文献报道的降低HCC合并PVTT术后复发率、提高生存率的方式主要包括术前放疗、术后辅助性TACE、术后口服索拉非尼等。术前辅助性放疗可控制原发灶及癌栓,对部分HCC合并PVTT患者可实现降期,在降低HCC术后复发率的同时不增加手术风险及术后肝衰竭风险。有研究显示,术后口服索拉非尼有助于降低复发率,但仍需要更多循证医学的证据支持。此外,术前TACE可能使PVTT患者获益,但同时会增加手术风险,目前文献暂不推荐。
介入治疗
介入治疗包括肝动脉灌注化疗(TAI)和TACE。TAI是治疗不可切除HCC合并PVTT的常用方法。主要适用于原发病灶不可切除的、PVTT Ⅰ及Ⅱ型、肝功能Child-Pugh A级或B级的患者。对于Ⅲ和Ⅳ型PVTT,TACE治疗目前仍存在较大争议。文献显示,对于Ⅰ、Ⅱ及Ⅲ型PVTT 患者,TACE组的疗效明显好于仅行TAI组或支持治疗组,栓塞剂直径越小对PVTT的治疗效果越好、患者副作用越小。对原发病灶不可切除的、PVTT Ⅰ及Ⅱ型患者首选TACE治疗;对于Ⅲ型PVTT患者,建议优先考虑介入治疗;Ⅳ型PVTT不建议行TACE治疗。
放疗
外放射治疗
肝脏对于放疗高度敏感,容易导致放疗诱导性肝病,所以以往放疗在HCC治疗方面的应用比较有限。但是随着放疗技术的发展,主要包括三维适形放疗(3DCRT)、调强放疗(IMRT)和体部立体定向放疗(SBRT),它们既可以提高靶区剂量,同时又能最大限度的保护正常的肝组织,适用于所有类型的HCC合并PVTT的患者。避免放射性肝病发生的关键在于在设计放疗计划时,把正常肝脏受照剂量限制在耐受范围内。Xi等回顾性报道41例晚期HCC患者,包括HCC合并PVTT 33例和HCC合并下腔静脉癌栓8例,使用SBRT对其进行治疗,其1年生存率为50.3%,中位生存期为13个月;是否对放疗敏感是其预后唯一的独立影响因素。共识提出:3DCRT/IMRT 95%计划靶区40~60 Gy,每次2~3 Gy;SBRT 95%计划靶区36~40 Gy,每次5~6 Gy。不论分割如何,放疗总剂量与HCC合并PVTT患者预后呈正相关。目前,临床上多支持3DCRT与TACE联合治疗,其疗效优于单独TACE或放疗,并建议TACE和放疗间隔时间在1个月之内。综上所述,外放射适用于原发病灶不可切除的、肝功能良好的各类型PVTT的患者。
内放射治疗
将放射性物质经肝动脉注入或直接植入瘤体内,不仅可以杀死肿瘤周边靠门静脉供血区残存的癌细胞,对瘤区门静脉分支癌栓也可直接杀伤,同时内放射治疗起栓塞作用,可阻断部分癌栓血供。目前国内使用最多的为125I粒子,粒子中心附近的γ射线最强,可最大限度的降低对正常组织的损伤。90Y核素具有辐射高能量纯β射线、半衰期短、组织穿透距离短等优点,是很好的局部内放射治疗用核素,对于像肝癌这样增殖较快的恶性肿瘤具有明显优势。在HCC中对90Y放疗栓塞有持续临床反应的基础是免疫反应。90Y微球产品对于不可切除的晚期肝癌患者的治疗是一个很好的补充,很有研究价值。目前90Y微球产品在我国香港和台湾已进行使用,大陆尚无90Y微球产品。目前,尚无内放射治疗的统一剂量标准。
系统治疗
靶向治疗
索拉非尼是一种口服的多激酶抑制剂,通过抑制血管内皮生长因子受体和血小板衍生生长因子受体的酪氨酸激酶发挥抗肿瘤细胞增殖及抗血管生成的作用。目前对于索拉非尼的研究主要有以下两个研究比较知名。有研究显示,索拉非尼与安慰剂比较,确实能延长生存时间。此外,索拉非尼联合TACE较单纯TACE明显延长HCC合并PVTT患者的生存期。但是索拉非尼的临床效果与患者的肝炎状态有关,且不能改善乙型肝炎相关HCC患者的预后情况,这极大的限制了索拉非尼在我国的应用。
令人振奋的是,Kudo等报道了一项开放性、多中心、随机化Ⅲ期非劣效性临床试验,在不可切除的HCC患者一线治疗中对比仑伐替尼与索拉非尼的疗效和安全性,也被称为REFLECT研究。该试验横跨亚太、欧洲和北美地区的20个国家、154个医疗点,随机分为仑伐替尼组(n=478)和索拉非尼组(n=476),两组患者在性别、年龄、肝功能状态等基线水平相似,受试者口服仑伐替尼(体质量≥60 kg者,12 mg,1次/d;体质量<60 kg者,8 mg ,1次/d)或索拉非尼(400 mg,2次/d),每28 d为一个周期。结果显示,仑伐替尼组的中位总体生存时间为13.6个月,不劣于索拉非尼组的12.3个月,达到非劣性标准;同时,仑伐替尼的中位疾病进展时间显著优于索拉非尼组(中位疾病无进展时间为8.9个月vs 3.7个月,P<0.000 1)。此外,与索拉非尼相比,仑伐替尼显示出更高的客观缓解率(24% vs 9%)。
在2017年中国临床肿瘤学会年会中,秦叔逵教授首次发布了REFLECT研究中国亚组分析数据,结果显示:与索拉非尼组比较,仑伐替尼组的中位总体生存时间达到了非劣性标准,且显著延长了4.8个月(15.0个月 vs 10.2个月,P=0.026)。此外,仑伐替尼组中位总体生存时间、中位无进展生存时间、中位疾病进展时间和客观缓解率也显著优于索拉非尼组,均具有统计学差异(P值均<0.05)。同时,对于合并HBV感染的HCC患者,仑伐替尼的中位总体生存时间为14.9个月,明显优于索拉非尼组的9.9个月,具有统计学差异(P<0.05)。综上所述,索拉非尼、仑伐替尼可使用于肝功能Child-Pugh A级和B级的各类型PVTT患者,瑞戈非尼可作为索拉非尼无效的PVTT患者的二线治疗。
全身化疗
以往认为化疗不适用于晚期HCC患者,但随着奥沙利铂的使用,越来越多文献报道晚期HCC患者可从全身化疗中受益。一项包含371例不适合行手术切除和局部治疗的晚期HCC患者(含PVTT患者)的多中心、随机对照研究,其中FOLFOX4(含奥沙利铂,n=184)方案化疗组的中位生存时间为6.40个月,高于含阿霉素方案化疗组(n=187)的4.97个月(P=0.07)。
免疫治疗
肝脏的门静脉系统及肝窦的特殊结构能够经常接触到外来抗原,从而使肝脏形成了免疫耐受(抑制)微环境,这种微环境使肝癌细胞更容易逃逸免疫杀伤。肝癌免疫治疗主要包括肿瘤疫苗治疗、过继细胞免疫治疗、免疫检查点抑制剂治疗和细胞因子治疗。其中细胞程序性死亡受体-1(PD-1)和细胞程序性死亡受体配体1(PD-L1)通路的免疫检查点抑制剂已经成为肿瘤治疗领域的一大热点。
2017年进行了一项Ⅰ/Ⅱ期、多中心、单臂临床试验,主要研究纳武利尤单抗(Nivolumab)治疗晚期肝癌的疗效,也称CheckMate-40研究。该研究共纳入晚期HCC患者262例,其中未经索拉非尼治疗的80例,经索拉非尼治疗失败的182例,试验分为剂量爬坡组(0.1~10 mg/kg,每2周1次,Ⅰ期试验,48 例))和剂量扩增组(3 mg/kg,每2周1次,Ⅱ期试验,214 例)。结果显示,剂量爬坡组的客观缓解率(ORR)达到了15%(7/48),显示了良好的安全性。剂量扩增组的ORR达到了20%(42/214),疾病控制率(DCR)达到了64%(138/214),6和9个月总体生存率分别达到了83%和74%。这是在所有临床试验中从未达到的疗效,也正是基于此项研究数据,美国食品药品监督管理局(FDA)已批准Nivolumab用于索拉非尼治疗失败的晚期HCC患者。目前,另一项全球多中心Ⅲ期临床研究CheckMate- 459研究正在进行中,观察Nivolumab与索拉非尼一线治疗晚期HCC的疗效。
局部治疗
目前HCC合并PVTT的局部治疗应用相对较少,主要包括门静脉支架、无水乙醇注射、射频消融、激光消融等。门静脉支架虽然不能减轻肿瘤负荷,但是可以增加门静脉血流,可有效降低门静脉压力,减少并发症的发生,同时也可以为其他治疗方法(如TACE、放疗等)赢得时间。局部消融治疗可迅速的减少肿瘤负荷并增加门静脉血流,但是有损伤门静脉壁及胆管、短期内PVTT复发率高等缺点,目前临床上应用较少。
对症支持治疗
对于肝功能为Child-Pugh C级,合并大量腹水或上消化道大出血、肝性脑病等不能耐受手术的患者,临床上仅能进行对症保守治疗。

